"Es propio de aquellos con mentes estrechas, embestir contra todo aquello que no les cabe en la cabeza" Antonio Machado
martes, 28 de abril de 2020
domingo, 26 de abril de 2020
martes, 21 de abril de 2020
sábado, 18 de abril de 2020
miércoles, 15 de abril de 2020
martes, 14 de abril de 2020
jueves, 9 de abril de 2020
MADURACIÓN CERVICAL CON BALOON AMBULATORIA
LECTURA DE
Induction of labour using prostaglandin E2 as an inpatient versus balloon catheter as an outpatient: a multicentre randomised controlled trial.
Beckmann M
BJOG. 2020 Apr;127(5):571-579. doi: 10.1111/1471-0528.16030. Epub 2019 Dec 17.
Aunque el
catéter con balón es un método seguro y eficaz de maduración cervical ,si confiere alguna
ventaja cuando se utiliza en un entorno ambulatorio es desconocido.
Un cambio en
la práctica al catéter con balón para pacientes ambulatorios para indicaciones
de inducción en embarazo de bajo riesgo podría reducir la duración de la estadía en el hospital
por muchas horas.
Comenzar la maduración del cervix en el hogar también puede resultar en una
experiencia de atención médica superior, costos reducidos y mejores resultados
maternos y perinatales.
Se realizó un ensayo controlado aleatorio (ICA) para
comparar la experiencia clínica de atención médica y los resultados económicos
del catéter deL baloon ambulatorio versus PG (dinoprostona) internada al término
Se realizó
un ICA multicéntrica en ocho hospitales australianos
Diseñado
para comparar sonda extrahospitalaria con dinoprostona hospitalaria para
maduración cervical
Participantes
Inducciones
de bajo riesgo, cefálicas de más de 37 semanas, por razones sociales, edad igual
o más de 40, o 41 semanas de EG. Embarazos de riesgo, cesárea anterior y
maduración cervical innecesaria fueron excluidos
Las
pacientes se randomizaron para PG vaginal intrahospitalaria (dinoprostona)-
previo CTGB- o para baloon transcervical con derivación intradomiciliaria-
Después de CTGB- se
colocó baloon com 80cc de suero salino- Un monitoreo de 30 minutos se realizó
posteriormente. Debía retornar a las 12
hs.
Luego de eso
se realizó oxitocina
347 para
baloon y 348 para dinoprostona fueron randomizados- los grupos eran comparables
en su composición. 71.9%
primigestas-71.4 % eran embarazos en
vías de prolongación-
No se
mostraron diferencias estadísticamente significativas en el modo de nacimiento
o las indicaciones fórceps y cesáreas entre los grupos. con balón versus PG.
Tampoco hubo diferencias estadísticamente
significativas en necesidad de analgesia, hemorragia posparto, el uso antibiótico
materno, prolapso del cordón umbilical .
La
incidencia meconio no difirió
estadísticamente, ni bajo Apgar o de pH (<7) a 5 min. La hiperestimulación
uterina ocurrió exclusivamente en el grupo PG
La mayoría
(86.5%) de las mujeres asignadas al azar a baloon fueron a su casa y se
quedaron en casa durante un período medio de 12.3 h.
La duración
de la estadía hospitalaria fue más corta para las mujeres en el grupo de baloon
en comparación con el grupo PG (P = 0.039), unque el tiempo desde el inicio de
la inducción hasta el nacimiento no difirió entre los grupos.
La
colocación de un baloon para maduración cervical en forma ambulatoria no se
asocia a resultados neonatales adversos comparado con dinopreostona en
pacientes internadas, aunque hay una tendencia a ser más favorables en el grupo
baloon.
Tampoco hay diferencias en
cesáreas o fórceps.
Sin embargo,
en el análisis de subgrupos por paridad, las mujeres nulíparas del grupo balón
ambulatorio experimentaron resultados neonatales adversos significativamente
menores, y las mujeres con partos anteriores (de este grupo) tuvieron una mayor
probabilidad de nacimiento por CS.
Este estudio
respalda la posición de que los catéteres con balón es el mejor método de
maduración cervical para mujeres nulíparas. También brinda la seguridad en la
práctica de que las mujeres nulíparas vuelvan a casa después de colocar el
balón, y que la probabilidad de
resultados adversos es baja
ESTRUCTURA COVID Y LOS IECA
LECTURA DE
Bringing Needed Structure to COVID-19 Drug Development
Posted on by Dr. Francis Collins
Con tanta información dando vueltas en estos días sobre la
pandemia de la enfermedad por coronavirus 2019 (COVID-19), sería fácil perderse
uno de los informes de ciencia básica más interesantes y significativos de las
últimas semanas.
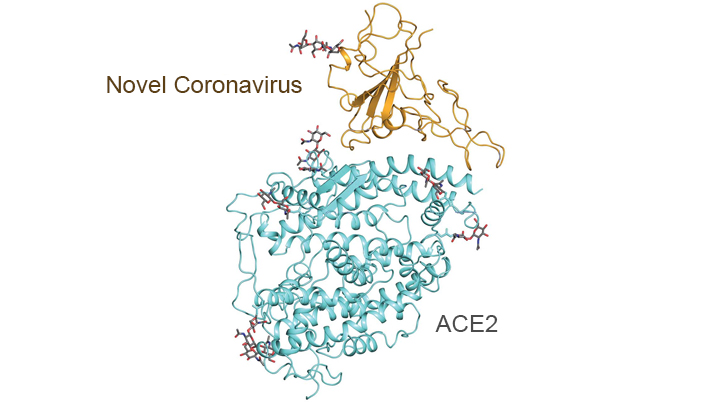
Es un artículo publicado en la revista Science que presenta una instantánea a escala atómica
que muestra la estructura 3D de la proteína espiga en el nuevo coronavirus
unido a una proteína de la superficie celular humana llamada ACE2, o enzima
convertidora de angiotensina 2. ACE2 es el receptor que usa el virus para
entrar.
Lo que hace que esta imagen sea tan importante es que
muestra, con detalles exquisitos, cómo el coronavirus se adhiere a las células
humanas antes de infectarlas y enfermar a las personas.
El mapa estructural de
esta interacción ayudará a guiar a los desarrolladores de fármacos, átomo por
átomo, a idear formas seguras y efectivas de tratar COVID-19.
Este nuevo trabajo, realizado por un equipo dirigido por
Qiang Zhou, del Instituto de Estudios Avanzados de Westlake, Hangzhou, China,
aprovechó una herramienta de imágenes de alta resolución llamada microscopía
crioelectrónica (cryo-EM).
Este enfoque implica moléculas de congelación
instantánea en nitrógeno líquido y bombardearlas con electrones para capturar
sus imágenes con una cámara especial. Cuando todo va bien, cryo-EM puede
resolver la estructura de complejos macromoleculares en cuestión de días,
incluido este que muestra la interacción entre una proteína viral y una
proteína humana.
ACE2 es un dímero compuesto por dos unidades muy similares.
El mapeo adicional reveló cómo la proteína de superficie del nuevo coronavirus
interactúa con ACE2, lo que indica cómo las dos proteínas de pico triméricas (3
unidades) del virus podrían unirse a un dímero ACE2.
La proteína ACE2 reside en la superficie de las células en
muchas partes del cuerpo humano, incluidos el corazón y los pulmones. Se sabe
que la proteína desempeña un papel destacado en el complejo sistema de
regulación de la presión arterial del cuerpo.
De hecho, una clase de
medicamentos que inhiben la ECA y las proteínas relacionadas con frecuencia se
recetan para ayudar a controlar la presión arterial alta o la hipertensión.
Estos inhibidores de la ECA disminuyen la presión arterial al relajar los vasos
sanguíneos.
Desde el brote de COVID-19, muchas personas se han
preguntado si tomar inhibidores de la ECA sería útil o perjudicial contra la
infección por coronavirus. Esto es de particular preocupación para los médicos
cuyos pacientes ya están tomando los medicamentos para controlar la
hipertensión.
De hecho, los datos de China y otros lugares indican que la
hipertensión es una de varias afecciones coexistentes que, según se informa,
son más comunes entre las personas con COVID-19 que desarrollan un síndrome
respiratorio agudo severo y potencialmente mortal.
En un nuevo informe publicado en el New England Journal of
Medicine de esta semana, un equipo de investigadores del Reino Unido y de EE.
UU., Apoyados en parte por los NIH, examinaron el uso de inhibidores de la ECA
y otros bloqueadores de los receptores de angiotensina (BRA) en personas con
COVID-19.
El equipo, dirigido por Scott D. Solomon del Hospital
Brigham and Women's y la Facultad de Medicina de Harvard, Boston, descubrió que
la evidencia actual en humanos es insuficiente para respaldar o refutar las
afirmaciones de que los inhibidores de la ECA o los BRA pueden ser útiles o
perjudiciales para las personas con COVID-19 .
Los investigadores concluyeron que estos medicamentos
antihipertensivos deben continuarse en personas que tienen o están en riesgo de
presentar COVID-19, y declararon: "Aunque los datos adicionales pueden
informar aún más el tratamiento de pacientes de alto riesgo ... los médicos
deben ser conscientes de las consecuencias de interrumpir prematuramente las
terapias probadas en respuesta a preocupaciones hipotéticas ".
Se están realizando investigaciones para generar los datos
necesarios sobre el uso de inhibidores de la ECA y medicamentos similares en el
contexto de la pandemia de COVID-19, así como para comprender más sobre los
mecanismos básicos que subyacen a esta enfermedad viral que se propaga
rápidamente.
Este tipo de investigación fundamental no es necesariamente
lo que ocupará los titulares, pero probablemente será vital para orientar el
diseño de medicamentos efectivos que puedan ayudar a controlar esta grave
crisis de salud global.
ESTRUCTURA DEL CORONAVIRUS Y VACUNA
Structural Biology Points
Way to Coronavirus Vaccine
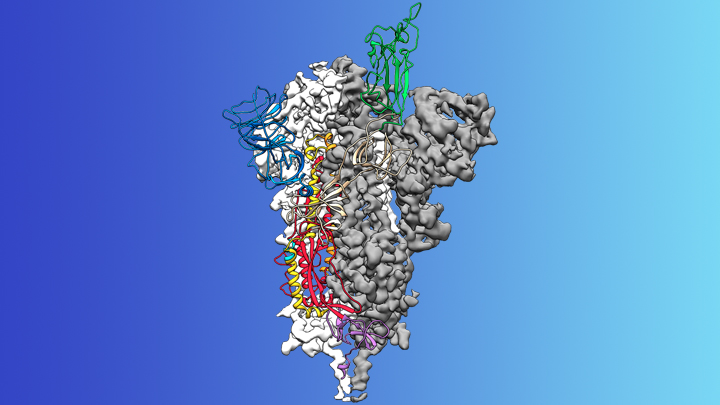
Algunas noticias alentadoras.
En un tiempo récord, un equipo
de investigadores financiado por los NIH ha creado el primer mapa a escala
atómica de un objetivo proteico prometedor para el desarrollo de vacunas .
Esta es la llamada proteína espiga en el nuevo coronavirus
que causa COVID-19. Como se muestra arriba, una parte de este apéndice de
superficie puntiaguda (verde) permite que el virus se una a un receptor en las
células humanas, haciendo que otras partes de la espiga fusionen las membranas
celulares virales y humanas.
Este proceso es necesario para que el virus ingrese a las
células y las infecte.
Los estudios preclínicos en ratones de una vacuna candidata
basada en esta proteína espiga ya están en marcha en el Centro de Investigación
de Vacunas (VRC) de los NIH, parte del Instituto Nacional de Alergias y
Enfermedades Infecciosas (NIAID).
Se espera que en las primeras semanas se inicie un ensayo
clínico de fase I de fase temprana de esta vacuna en personas.
Pero habrá muchos más pasos después de eso para probar la
seguridad y la eficacia, y luego escalar para producir millones de dosis.
Solo dos semanas después de que los científicos chinos
informaron la primera secuencia del genoma del virus, McLellan y sus colegas
diseñaron y produjeron muestras de su proteína espiga.
Después de bloquear la proteína espiga en la forma que toma
antes de fusionarse con una célula humana para infectarla, los investigadores
reconstruyeron su mapa estructural 3D a escala atómica en solo 12 días.
Sus resultados, publicados en Science, confirman que la
proteína de pico en el virus que causa COVID-19 es bastante similar a la de su
pariente cercano, el virus del SARS.
También parece unirse a las células humanas más fuertemente
que el virus del SARS, lo que puede ayudar a explicar por qué el nuevo
coronavirus parece propagarse más fácilmente de persona a persona,
principalmente por transmisión respiratoria.
El equipo de McLellan y sus contrapartes VRC del NIAID
también planean usar la proteína de pico estabilizada como una sonda para
aislar anticuerpos producidos naturalmente de personas que se han recuperado de
COVID-19. Dichos anticuerpos pueden formar la base de un tratamiento para las
personas que han estado expuestas al virus, como los trabajadores de la salud.
El NIAID ahora está trabajando con la empresa de
biotecnología Moderna, Cambridge, MA, para utilizar los últimos hallazgos para
desarrollar un candidato a vacuna que utilice ARN mensajero (ARNm), moléculas
que sirven como plantillas para producir proteínas.
El objetivo es dirigir al cuerpo
a producir una proteína espiga de tal manera que provoque una respuesta inmune
y la producción de anticuerpos.
Se espera que comience un ensayo clínico temprano de la
vacuna en personas en las próximas semanas. Otras vacunas candidatas también
están en desarrollo preclínico.
Mientras tanto, el primer ensayo clínico en los EE. UU. Para
evaluar un tratamiento experimental para COVID-19 ya está en marcha en la
unidad de biocontención del Centro Médico de la Universidad de Nebraska.
A pesar de que este calendario potencialmente romperá todos
los récords de velocidad anteriores, una vacuna segura y efectiva tomará al
menos otro año para estar lista para un despliegue generalizado.
jueves, 2 de abril de 2020
VACUNA PARA COVID-19 ?
lectura de
Perspective
Developing Covid-19 Vaccines at Pandemic Speed
Nicole Lurie, M.D
March 30, 2020 DOI:
10.1056/NEJMp2005630
Problemas al desarrollar rápidamente una vacuna contra el
SARS-CoV-2
Durante la última década, se le han pedido vacunas que
respondan urgentemente a las epidemias de influenza H1N1, Ébola, Zika y ahora
SARS-CoV-2.
Una vacuna contra la influenza H1N1 se desarrolló
relativamente rápido, en gran parte porque la tecnología de la vacuna contra la
influenza estaba bien desarrollada y los reguladores habían decidido
previamente que las vacunas hechas con plataformas basadas en células y óvulos
podían licenciarse bajo las reglas ya utilizadas frente a un cambio de cepa.
Aunque una vacuna monovalente contra la gripe H1N1 no estaba
disponible antes de que la pandemia alcanzara su punto máximo en el hemisferio
norte, estuvo disponible poco después como una vacuna independiente y
finalmente se incorporó a las vacunas contra la influenza estacional
disponibles comercialmente.
Las vacunas para el síndrome respiratorio agudo severo (SARS),
el Ébola y el Zika no siguieron un camino similar. Las epidemias de SARS y Zika
terminaron antes de que se completara el desarrollo de la vacuna, y las
agencias de financiación federales reasignaron fondos que se habían
comprometido su desarrollo, dejando a los fabricantes con pérdidas
financieras y retrasando otros programas de desarrollo de vacunas.
La organización, Coalition for Epidemic Preparedness
Innovation (CEPI), es una organización internacional no gubernamental financiada
por Wellcome Trust, la Fundación Bill y Melinda Gates, la Comisión Europea y
ocho países (Australia, Bélgica, Canadá, Etiopía, Alemania, Japón, Noruega y el
Reino Unido) están apoyando el desarrollo de vacunas contra cinco patógenos
epidémicos en la lista de prioridades de la Organización Mundial de la Salud
(OMS).
Su objetivo es desarrollar reservas de vacunas en
investigación para cada patógeno después de que dichas vacunas hayan completado
los ensayos de fase 2a, esperando que se sometan a ensayos clínicos durante
brotes futuros.
Una plataforma ideal respaldaría el desarrollo desde la
secuenciación viral hasta los ensayos clínicos en menos de 16 semanas, lo que
hoy existe para influenza pero no para covid 19.
Incluso con plataformas novedosas, el desarrollo de la
vacuna SARS-CoV-2 plantea desafíos.
Primero, aunque la proteína espiga del
virus es un inmunógeno prometedor para la protección, la optimización del
diseño del antígeno es fundamental para garantizar una respuesta inmune óptima y hay un debate sobre el mejor enfoque, si debe dirigirse a la proteína
de longitud completa o solo al dominio de unión al receptor.
El desarrollo es un
proceso largo y costoso. La deserción es alta y, por lo general, se requieren
varios candidatos y muchos años para producir una vacuna autorizada.
Debido al costo y las altas tasas de fracaso, los
desarrolladores suelen seguir una secuencia lineal de pasos, con múltiples
pausas para el análisis de datos o las comprobaciones del proceso de
fabricación.
Desarrollar una
vacuna rápidamente requiere un nuevo paradigma de pandemia , con un inicio
rápido y muchos pasos ejecutados en paralelo antes de confirmar un resultado
exitoso de otro paso, lo que resulta en un riesgo financiero elevado.
Por ejemplo, para plataformas con experiencia en humanos,
los ensayos clínicos de fase 1 pueden proceder en paralelo con las pruebas en
modelos animales.
Tan pronto como China anunció que se había identificado un
nuevo coronavirus como la causa del brote de Wuhan, CEPI contactó a sus socios
que estaban desarrollando vacunas MERS o trabajando en nuevas plataformas.
Con el potencial de un mayor apoyo financiero, ellos y otros
comenzaron el desarrollo de la vacuna tan pronto como se publicó la primera
secuencia de genes, y el desarrollo está avanzando rápidamente.
El candidato a SARS-CoV-2 basado en ARNm ingresó a un ensayo clínico de fase 1 el 16 de
marzo, menos de 10 semanas después de que se liberaran las primeras secuencias
genéticas;
El primer ensayo de fase 1 con una vacuna no replicativa
basada en vectores tiene autorización reglamentaria para comenzar los estudios
de fase 1 en China. Se espera que otros ensayos de fase 1 de vacunas de ácido
nucleico comiencen en abril.
Para algunos candidatos, ahora se fabrica material de ensayo
clínico adicional para estudios de fase 2; proceder rápidamente más allá de los
ensayos de la fase 2 significa que la fabricación deberá ampliarse a niveles
comerciales antes de que estén disponibles datos sustanciales de seguridad e
inmunogenicidad.
Crear capacidad de fabricación puede costar cientos de
millones de dólares. Además, para las nuevas tecnologías de plataforma, la
mayoría de las cuales no tienen licencia, nunca se ha realizado la fabricación
a gran escala, por lo que se deben identificar instalaciones capaces de
producir grandes cantidades de producto, transferir tecnologías y adaptar los
procesos de fabricación, todo sin saber si el candidato a la vacuna es viable
No es seguro que estas nuevas plataformas sean escalables o
que la capacidad existente pueda producir cantidades suficientes de vacuna lo
suficientemente rápido.
Por lo tanto, es fundamental que las vacunas también se
desarrollen utilizando métodos probados y verdaderos, incluso si pueden tomar
más tiempo para ingresar a los ensayos clínicos o dar como resultado grandes
cantidades de dosis.
La realización de ensayos clínicos durante una pandemia
plantea desafíos adicionales. Es difícil predecir dónde y cuándo ocurrirán los
brotes y preparar los sitios de prueba para que coincidan con la preparación de
la vacuna para la prueba.
Además, si las vacunas múltiples están listas para ser
probadas en la segunda mitad de 2020, será importante no saturar los sitios o
cargar a los países y sus autoridades éticas y reguladoras con múltiples
ensayos, como sucedió con el tratamiento del Ébola durante el brote 2013-2016.
En una situación de alta mortalidad, las poblaciones
pueden no aceptar ensayos controlados aleatorios con grupos de placebo
Una posible forma de avanzar sería probar varias vacunas
simultáneamente en un diseño de ensayo adaptativo utilizando un solo grupo de
control compartido, para que más participantes reciban una vacuna activa.
Este enfoque tiene ventajas, pero puede ser complejo desde
el punto de vista logístico y estadístico, y los desarrolladores a menudo quieren
evitar ensayos que puedan generar datos comparativos cara a cara.
El CEPI, como organización relativamente nueva, no había
establecido mecanismos e instrumentos financieros para apoyar el desarrollo de
vacunas pandémicas y necesitará recaudar fondos adicionales para ver las
vacunas SARS-CoV-2 a través del desarrollo y la ampliación de los procesos de
fabricación.
Si bien pueden estar disponibles varios millones de dosis de
vacunas como subproducto del desarrollo, en una situación de pandemia, una vez
que los candidatos a la vacuna se prueban seguros y efectivos, las dosis deben
fabricarse en grandes cantidades.
Aunque algunos países de altos ingresos pueden pagar por el
desarrollo y la fabricación teniendo en cuenta a sus propias poblaciones, no
existe una entidad global responsable de financiar u ordenar la fabricación de
vacunas.
Se están llevando a cabo conversaciones con las partes
interesadas mundiales sobre la organización y financiación de la fabricación,
adquisición y entrega de vacunas a gran escala.
Finalmente, las pandemias generarán una demanda simultánea
de vacunas en todo el mundo. Se necesitarán estudios clínicos y serológicos
para confirmar qué poblaciones permanecen en mayor riesgo una vez que las
vacunas estén disponibles y podrían formar la base para establecer un sistema
de asignación de vacunas justo a nivel mundial.
Algunos países del
Grupo de los Siete ya han pedido un sistema global de este tipo, cuya
planificación debe comenzar mientras se desarrolla la vacuna.
Suscribirse a:
Entradas (Atom)